


最近做实验不顺利,经常得不到目标蛋白,要么就是蛋白损失很大。怎么办呢?
由于超滤管使用不恰当或是超滤知识缺乏引起的问题,简直成了实验汪们蛋白实验不成功、效率低下的最常见原因之一。比如说:
为什么我截留分子量选择没错,蛋白有时候却会漏出在滤出液中?
为什么我用浓缩后的蛋白做下游分析的时候发现有干扰?
用超滤管来分离两种蛋白可以吗?
有时候我用超滤离心管连水都离不下来,可能的原因是?
超滤管可以用来脱盐和浓缩核酸吗?
如何给超滤管灭菌?

于是,膜过滤和超滤专家专门写了一篇攻略,帮助实验小白们成功在通往技术大牛的道路上打怪升级。
废话不多说,上干货,小板凳搬好了哦!
我们先来看看重点问题怎么解决
Q
为什么我截留分子量选择没错,
蛋白有时候却会漏出在滤出液中?
A
导致漏蛋白甚至检测不到蛋白的原因很复杂,应优先根据样品调整工艺,因为同一种膜、截留分子量和装置组合对于不同的蛋白质类别甚至物种而言可能并非最优之选。
在选择过程中,应首先执行以下步骤:
考虑样品和分子特性:比如改变pH 可能增加构象改变的风险,而降低温度可能降低浓缩效率等。
选择正确的膜:众所周知,超滤没有太多的膜选项,但您应对再生纤维素(RC)、Hydrosart® 和聚醚砜(PES)材料进行测试,以确定哪种材料可为您的特定材料提供最低的非特异性结合和最优的回收率。
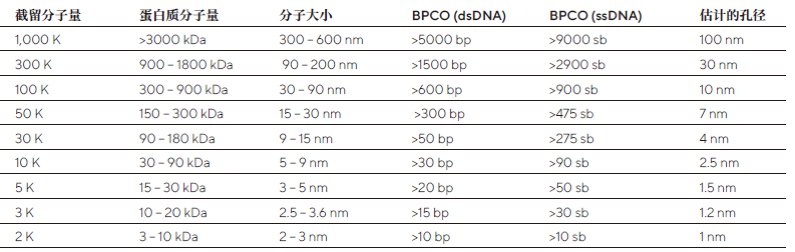
选择合适的截留分子量,通常是靶标1/3大小的截留分子量最适合。但有时则需要更小的孔径来满足回收率的要求。如果在病毒和核酸样品,可参看下面截留分子量和病毒颗粒分子大小以及核酸大小的换算表。
选择合适的装置:赛多利斯拥有适用于低浓度样品、DNA、蛋白质、病毒、过滤应用等广泛的装置选项;选择合适的装置可以有效改善结果。
使用合适的装置处理方法:例如预冲洗以去除分析物或用非干扰蛋白冲洗以钝化结合位点并减少损失。
考虑样品控制方法,例如使用装置内的“死体积”移走所有截留物,或预灌装滤液管以控制截留物的最终体积。
截留分子量和病毒颗粒分子大小以及核酸大小的换算表
Q
为什么我用浓缩后的蛋白
做下游分析的时候发现有干扰?
A
超过滤薄膜含有微量甘油和叠氮化钠。如果此材料干扰分析,可用缓冲液或去离子水预清洗。如果干扰仍然存在,用 0.1 N NaOH 清洗,然后用缓冲液或去离子水再次清洗后甩干。如果必须用NaOH处理的时候,推荐试用聚醚砜(PES)膜,因为比(再生纤维素)RC膜更耐NaOH,同时提醒NaOH不能过夜浸泡。
Q
用超滤管来分离两种蛋白可以吗?
A
因为超滤膜的孔径不是规则的结构,所以不能进行精确的分离,所以按照经验,我们推荐两个蛋白的分子量要相差一个数量级(10倍)以上才可以进行分离。另外,赛多利斯独有的300k,1000k和0.2um的超滤管可以实现10倍以上分子量差异的蛋白粗分离。
小编为大家整理了精编完整版《实验室超滤常见问题》 ,想了解其他注意事项的童鞋可以戳下面的按钮获取全文哦!现在还有试用活动进行中,可以免费获得RC超滤管一支~



